Juliana Moyses Leite Abdalla
Mestre em Saude da Mulher pela Universidade Federal de Minas Gerais
Pós-graduação em Medicina Fetal na Cetrus, São Paulo
Fellow em Medicina Fetal com o Prof Philippe Jeanty, EUA
Certificado de Atuação em Medicina Fetal – FEBRASGO
Simone Pedra
Doutora em Ciências pela USP
Chefe da área da ecocardiografia pediátrica e fetal do Instituto Dante Pazzanese de Cardiologia
Coordenadora da Unidade Fetal do HCor
Cleisson Fábio Andrioli Peralta
Mestre e Doutor em Medicina pela Universidade de São Paulo
Introdução
A doença cardíaca congênita ocorre em aproximadamente 6 a cada 1.000 nascidos vivos. 1 É a causa mais comum de morte infantil devido a malformações congênitas nos Estados Unidos e em outros países desenvolvidos.1 O desenvolvimento de técnicas cirúrgicas fetais e os avanços na tecnologia ultrassonográfica possibilitaram o início do tratamento de algumas cardiopatias congênitas durante a vida fetal. 1
A premissa básica para o desenvolvimento da terapia cirúrgica cardíaca fetal é que uma intervenção pré-natal poderá remodelar a morfologia cardíaca e alterar favoravelmente a história natural da doença, resultando em melhores prognósticos pré e pós-natais.
A valvoplastia aórtica fetal foi relatada pela primeira vez por Maxwell et al. ou e cols em 1991 no Reino Unido. 2 Os autores apresentaram dois casos submetidos à dilatação da valva aórtica para a prevenção de hipoplasia do coração esquerdo no 2o trimestre da gestação.2 A partir de então, com melhor seleção de pacientes e evolução tecnológica de cateteres e imagens, as intervenções cardíacas fetais tornaram-se opções terapêutica plausíveis nos últimos 10 a 15 anos.
O objetivo deste capítulo é discutir as principais indicações, aspectos técnicos, resultados pré- e pós-natais desses procedimentos.
Indicações e justificativas para terapia fetal
O tratamento de fetos com cardiopatias é uma situação que envolve questões éticas e legais. Em muitos países, o diagnóstico pré-natal da cardiopatia permite a opção de interrupção da gestação. No Brasil, onde esta conduta não é legalizada, ou em alguns países em que há restrições legais sobre o limite de idade gestacional para interrupção, as intervenções fetais tornam-se opções plausíveis às mulheres que desejam continuar a gravidez.
As questões éticas relacionadas à terapia fetal articulam-se em meio à experimentação, à inovação terapêutica e aos resultados comprovados. A capacidade de diagnosticar e intervir nas doenças fetais evoluiu mais rapidamente do que a compreensão sobre suas fisiopatologias e evoluções em curto e longo prazo. O entusiasmo pela intervenção fetal deve ponderar os interesses da gestante e da família, os resultados conhecidos sobre a evolução de fetos tratados e não tratados e a necessidade de abandonar terapias comprovadamente não eficazes. Assim sendo, a cardiologia fetal intervencionista é um modelo em que as considerações éticas devem orientar as decisões, visando minimizar danos e aumentar a taxa de sucesso das intervenções propostas.
Descrição técnica
Algumas das ferramentas utilizadas nestes procedimentos merecem comentários. A fim de garantir uma intervenção bem-sucedida, a seleção adequada de casos e os aspectos técnicos devem ser respeitados. As intervenções devem ser realizadas em centros com equipe de obstetrícia experiente em acompanhamento de gestação de alto risco. Embora unidades especiais tenham sido projetadas e usadas para esses procedimentos ao redor do mundo, as intervenções no Brasil geralmente são conduzidas na sala do centro cirúrgico por uma equipe multidisciplinar.
A equipe multidisciplinar inclui um especialista em medicina fetal, um cardiologista fetal/pediátrico e um especialista em intervenções em cardiopatias congênitas. O cardiologista fetal é responsável pela seleção do paciente e pela avaliação ecocardiográfica pré, intra e pós operatória, além do acompanhamento pós-natal. O especialista em medicina fetal realiza o posicionamento e anestesia fetal e controla simultaneamente a agulha de punção e o transdutor de ultrassom. Os especialista em intervenções em cardiopatias congênitas manipulam os cateteres e os fios.
Apesar de pequenas variações existentes na avaliação de diferentes anormalidades cardíacas congênitas, os principais instrumentos utilizados para esses procedimentos são basicamente os mesmos.
Cuidados peri-operatórios maternos e fetais
O jejum materno deve começar cerca de 8 horas antes do procedimento, que é realizado sob bloqueio espinhal. Evita-se a anestesia geral, que pode dificultar o posicionamento fetal, mais facilmente realizado quando este econtra-se ativo. A anestesia local poderia eventualmente ser uma opção, entretanto, a maioria das gestantes não tolera a manipulação uterina para posicionamento do feto. Dependendo da ansiedade materna, a sedação pode ser usada após anestesia fetal 3.
Para o relaxamento uterino, várias opções podem ser consideradas. Em geral, a nifedipina oral (20 mg, 8/8 horas) é iniciada cerca de 12 horas antes do procedimento, com duas doses adicionais após a intervenção. Outras opções são terbutalina (intravenosa ou subcutânea) ou atosiban (intravenosa) durante e após o procedimento. 3
Depois da anestesia materna, o feto manipulado (versão externa se necessário) e anestesiado com injeção intramuscular de pancurônio (20 mg/Kg), fentanil (10 mg/Kg) e atropina (20 mg/Kg) com o uso de uma agulha de Chiba 20-gauge. Em casos de polidrâmnio, é obrigatório o esvaziamento da cavidade amniótica antes da intervenção cardíaca, até se obter um maior bolsão vertical de liquido amniótico inferior a 8 cm. Esse processo tem como objetivo evitar o deslocamento do feto durante o procedimento.
Principais ferramentas utilizadas durante o procedimento
Todas as etapas desde a versão externa do feto até o percurso da agulha no coração e o posicionamento dos cateteres são realizadas sob monitorização ultrassonográfica contínua. Uma agulha de Chiba de 17-18-Gauge atravessa o abdômen materno, a parede uterina, a parede torácica fetal até alcançar a câmara cardíaca (ventrículos esquerdo ou direito ou átrio esquerdo).
A entrada no coração ocorre direcionada ao alvo, ou seja, no ápice cardíaco com a ponta da agulha orientada para as válvulas semilunares atrésicas ou estenosadas, ou direcionada ao átrio esquerdo no caso de septo interatrial restrito. São usados sistemas pré-marcados de balão coronariano. (Figura 1). O fio é protegido com uma fita com a sua ponta avançando de 1 a 2 cm além da ponta do balão do cateter. O eixo do balão do cateter é marcado com uma fita que encosta a ponta da agulha quando o sistema é avançado. O diâmetro do balão deve ser 20-40% maior do que o diâmetro do anel valvar. A nítida visualização do fio guia na aorta ascendente para a valvoplastia aórtica ou no do ducto arterioso para a valvoplastia pulmonar é recomendada antes da insuflação do balão. O balão coronariano é insuflado 2 a 4 vezes com um indicador de pressão. 3
Após a dilatação da valva ou do septo interatrial, todo o sistema (agulha + balão + fio) é retirado do coração fetal e do corpo materno como uma unidade para evitar a separação do balão do eixo do cateter. Em caso de hemopericárdio e tamponamento, o pericárdio é perfurado com agulha Chiba 20-Gauge sob guia ultrassonográfica e drenado. Se ocorrer bradicardia fetal grave e persistente, epinefrina e atropina são injetadas diretamente na cavidade ventricular.
O uso de stents e cateteres especiais ao invés de balões coronários são outras opções para os procedimentos de átrio-septostomia, embora a experiência mundial com estes dispositivos seja limitada.
Principais ferramentas utilizadas após o procedimento
Após a conclusão dos principais passos da intervenção cardíaca fetal, o monitoramento fetal é realizado por ultrassonografia. Além de uma avaliação inicial do sucesso do procedimento, o estudo Dopplervelocimétrico das artérias umbilical e cerebral média é usado para avaliar a estabilidade hemodinâmica fetal. A velocidade sistólica do pico da artéria cerebral média é medida para detectar possíveis quadros de anemia fetal decorrentes de sangramento fetal excessivo.
A imagem por ressonância magnética também é uma ferramenta útil que pode ser usada especialmente em casos de hemorragia fetal grave e tamponamento seguido de bradicardia persistente e/ou parada cardíaca. Permite a detecção de danos cerebrais fetais agudos, por meio da avaliação da restrição de difusão de água e pode ser realizada até 7 a 10 dias após o procedimento 3.
Em resumo, as ferramentas utilizadas para intervenções cardíacas fetais são relativamente simples e amplamente disponíveis. Apesar de novos instrumentos estarem continuamente em desenvolvimento, parece que o sucesso da intervenção cardíaca fetal depende principalmente da experiência de uma equipe multidisciplinar dedicada e competente.
Complicações
A morbidade materna é raramente descrita na literatura. No entanto, uma simples punção com agulha fina no útero pode causar sangramento, infecção, rotura prematura pré-termo de membranas ou estimular o parto prematuro. A prevenção adequada das contrações uterinas antes, durante e depois desses procedimentos evita principalmente o estímulo ao parto prematuro.
A instabilidade hemodinâmica fetal devido a bradicardia e hemopericárdio significativo são as complicações mais comuns.2 Vários mecanismos foram postulados para explicar esta instabilidade, incluindo uma resposta bradicárdica mediada por colina, desencadeada por reflexo ventricular e potencializada pela retirada simpática e redução do débito cardíaco resultante de distorção ventricular durante a punção ventricular. Devido a alta frequência dessas complicações, a administração de atropina profilática durante a anestesia fetal, a injeção terapêutica intracardíaca de epinefrina e atropina e a drenagem pericárdica imediata devem ser consideradas parte do processo. Embora a bradicardia significativa seja quase exclusiva de procedimentos que envolvam acesso ventricular, ocasionalmente pode ser vista em septoplastias atriais, especialmente em procedimentos prolongados.2
A perda fetal também pode ocorrer. Embora seja mais comumente associada à instabilidade hemodinâmica e ao hemopericárdio, outros fatores como anestesia fetal e materna e estímulos mecânicos também podem desempenhar um papel.
Indicações
Estenose aórtica
Estenose aórtica ocorre em 0.2 a 0.5/1000 nascimentos, sendo 91% dos casos formas críticas. 3A forma usual da obstrução da via de saída esquerda é a valvar. O diagnóstico se baseia em uma valva aórtica displásica (com espessamento dos folhetos) e estenótica (com diminuição de movimentos), o que causa aumento das velocidades ao estudo Doppler. O comprometimento da função ventricular pode ser visto nos casos mais graves.
A estenose aórtica fetal pode estar associada a diferentes alterações morfológicas das valvas, incluindo valvas bicúspide, tricúspide, unicúspide ou unicomissurais. O anel valvar aórtico pode ser normal ou hipoplásico. No momento do diagnóstico, a função ventricular esquerda pode ser normal ou gravemente comprometida com graus variáveis de fibroelastose endocárdica, regurgitação mitral e hipoplasia da aorta ascendente. 3
Alguns fetos com estenose aórtica crítica podem evoluir para hipotrofia ventricular esquerda. Esta progressão pode ser antecipada quando algumas anormalidades de fluxo são observadas em ecocardiogramas fetais realizados entre 20 e 29 semanas de gestação.
A dilatação valvar no período fetal têm como objetivo evitar a progressão da hipotrofia ventricular esquerda, permitindo a manutenção de uma circulação biventricular pós-natal.
Os critérios de elegibilidade para valvoplastia aórtica intra-útero são aplicáveis a dois grupos de fetos: 1,3
· Com estenose aórtica crítica progredindo para síndrome da hipoplasia do coração esquerdo. O diagnóstico baseia-se na visibilização ecocardiográfica de valva aórtica espessada, imóvel, com fluxo turbulento e diminuição do fluxo anterógrado no estudo Doppler. Todos os fetos devem demonstrar o fluxo sanguíneo reverso no arco aórtico, com fluxo da esquerda para a direita através do forame oval.
· Com estenose aórtica crítica e regurgitação mitral grave, átrio esquerdo gigante e hidropisia fetal. Neste caso, o procedimento é realizado para diminuir o risco de morte fetal devido a hidropisia associada a compressão do ventrículo direito.
O momento exato da realização do procedimento deve se basear na certeza da progressão para hipoplasia ventricular. Caso contrário, provavelmente o feto será submetido a riscos, sem benefícios claramente definidos. Preferencialmente, a valvoplastia aórtica é realizada antes da 30a semana de gravidez. Se o procedimento for postergado, o comprometimento no crescimento ventricular pode torna-se irreversível. Portanto, a definição do momento exato para o procedimento é crucial, dependendo em grande parte da previsão ecocardiográfica da progressão da estenose aórtica para a hipoplasia do ventrículo esquerdo.
Os melhores candidatos são os fetos com ventrículo esquerdo dilatado não hipoplásico, com disfunção ventricular, fluxo esquerdo-direito no forame oval, fluxo reverso na aorta, fluxo anormal na valva mitral e feto hidrópico.
Em relação ao prognóstico, é frequente observar a melhora progressiva intra-útero da função ventricular esquerda. Em aproximadamente 30% dos fetos submetidos a dilatação valvar aórtica a circulação biventricular neonatal é alcançada. 3 Fetos com cavidades ventriculares esquerdas reduzidas podem se beneficiar do procedimento devido a melhora do fluxo coronário e à preservação da função miocárdica, com impacto positivo nos resultados neonatais. 3Além disso, promover o fluxo através da valva aórtica fetal pode ajudar a minimizar anormalidades secundárias no desenvolvimento neurológico. 3 (Figura 2)
Aproximadamente 300 casos de valvoplastias aórticas fetais já foram realizados, um terço deles em uma única instituição (Boston Children’s Hospital).4 O sucesso técnico da dilatação valvar aórtica fetal foi de 80 a 90%, com taxa de morte fetal que variou de 5 a 20%. 4
É importante salientar que a intervenção fetal é parte do tratamento do feto, que se completa em todos os casos após o nascimento. 4 O principal objetivo da valvoplastia aórtica fetal é contribuir para redução da progressão da doença para hipoplasia do ventrículo esquerdo. Assim sendo, o desfecho mais importante para avaliação da eficácia do procedimento é a possibilidade de correção biventricular no pós-natal e não apenas o sucesso técnico e as modificações hemodinâmicas obtidas no feto.
Os dados disponíveis sobre a possibilidade de correção definitiva biventricular na sequência da valvoplastia aórtica fetal são inconsistentes na literatura. Isso resulta, em parte, da diversidade dos quadros clínicos elegíveis para a intervenção fetal. O grupo de Boston avaliou 100 fetos submetidos a valvoplastia aórtica, dos quais 38 atingiram a circulação biventricular 4.
Pedra et al, entre Julho de 2007 e Dezembro de 2015, realizaram 22 valvoplastias em 20 fetos com estenose aórtica crítica. 3 Em 90% dos casos a dilatação foi realizada com sucesso. Em dois fetos não foi possível o acesso através da valva provavelmente devido a idade gestacional precoce (22 e 23 semanas). Um desses fetos evoluiu com óbito um dia depois da cirurgia.
Estenose pulmonar com septo íntegro
A estenose pulmonar com septo íntegro é um estreitamento da via de saída do ventrículo direito. O diagnóstico pré-natal é possível por meio da identificação de assimetria das dimensões ventriculares, com hipertrofia das paredes do ventrículo direito, aumento das dimensões do átrio direito, espessamento da valva pulmonar e insuficiência tricúspide. O estudo Doppler contribui para a identificação da valva pulmonar estenótica, devido ao aliasing no local do fluxo sanguíneo com alta velocidade. 3
A atresia pulmonar com septo interventricular íntegro é a oclusão completa da via de saída do ventrículo direito, não havendo comunicação entre a via de saída direita e o tronco pulmonar.
A primeira valvoplastia pulmonar fetal foi realizada em 2002 por Tulzer et al. em um feto com falência cardíaca na 28a semana de gestação estenose crítica. 3 Após o procedimento houve significativo crescimento da cavidade ventricular direita, permitindo a sobrevivência do recém-nascido com circulação biventricular.
A intervenção fetal nesses casos tem dois objetivos:
· Melhorar a sobrevida de fetos hidrópicos por descompensação ventricular direita grave;
· Reduzir a morbidade neonatal ao permitir melhor crescimento ventricular, o que aumenta a chance de correção biventricular.
Os critérios de elegibilidade para valvoplastia pulmonar são aplicáveis aos fetos com:
1. Estenose grave ou atresia membranosa na valva pulmonar com:
· Septo interventricular integro
· Fluxo reverso no ducto arterioso
· Diminuição no ritmo de crescimento ventricular direito em um período de 4 a 6 semanas.
· Hipoplasia do coração direito (ventrículo direito identificável mas qualitativamente pequeno)
· Hidropisia fetal
· Fluxo tricúspide anormal
As contra-indicações para o tratamento intrauterino consistem em:
· Atresia não membranosa da via de saída do ventriculo direito
· Defeito de septo ventricular
· Circulação coronária dependente do ventrículo direito (dilatação das comunicações coronário-cavitárias ou sinusóides)
O candidato ideal para tratamento intra-uterino é o feto com obstrução ao nível valvar isolada, com via de saída desenvolvida e ventrículo direito hipoplásico. O ritmo de crescimento do ventrículo direito irá determinar o momento adequado para correção. Se não houver crescimento da cavidade ventricular direita em um intervalo de 4 a 6 semanas, a reversão espontânea da obstrução é pouco provável e a desobstrução cirúrgica pode ser a melhor opção de conduta. A valvoplastia pulmonar deverá ser realizada preferencialmente entre a 28a e 29a semana de gestação.
O tratamento fetal consiste na dilatação da valva pulmonar com balão. O sucesso imediato do tratamento é confirmado pela visibilização de fluxo ao Doppler através da valva pulmonar. (Figura 3) As principais complicações relacionadas ao procedimento são o derrame pericárdico e os episódios de bradicardia persistente, que ocorrem em aproximadamente 35-40% dos fetos. 3
Em 2014, Tulzer et al. relataram a experiência com 10 fetos submetidos a 12 procedimentos de valvoplastia pulmonar. A idade gestacional média da intervenção foi de 27 semanas. O sucesso do tratamento ocorreu em 8 casos, confirmado pelo aumento do fluxo ventricular direito. Em apenas um caso houve evolução para circulação univentricular. 3 Até o momento, existem apenas 40 casos publicados sobre estas intervenções. 4
Forame oval restritivo
Na circulação fetal, os dois ventrículos funcionam em paralelo e o forame oval é importante provedor de sangue oxigenado da veia umbilical para o coração esquerdo, aorta e cérebro. O septo primum funciona como a válvula do forame oval, podendo ser identificado no lado esquerdo do septo atrial.
O forame oval restritivo constitui uma redução do orifício de passagem do fluxo interatrial. Pode estar associado a um mal desenvolvimento primário do septo atrial ou secundário a um aumento da pressão atrial esquerda presente em doenças obstrutivas do coração esquerdo.
Com a ultrassonografia observa-se dilatação das câmaras cardíacas direitas, com insuficiência tricúspide, que pode culminar em alteração contrátil do ventrículo direito. O septo primum fica abaulado para o átrio esquerdo, com diminuição de sua mobilidade. O estudo Doppler permite a identificação de aliasing no fluxo de sangue no forame oval.
A intervenção cirúrgica pré-natal visa melhorar a chance de sobrevida desses fetos. É uma opção para fetos com doenças obstrutivas do coração esquerdo, com restrição grave do forame oval, entre elas:
1. Síndrome da hipoplasia do coração esquerdo. Condição associada a taxas de 50% de mortalidade nos casos não tratados intra-útero.3
2. Estenose aórtica crítica com regurgitação mitral acentuada. Resulta em falência ventricular esquerda com taxas de sobrevida no período neonatal inferiores a 20%. 3
A septoplastia atrial fetal deve ser realizada preferencialmente entre a 26a e a 32a semana de gestação (Figura 4). Os dados disponíveis na literatura são limitados à experiência de poucos centros, com números reduzidos de casos. A maior casuística foi descrita pelo grupo de Boston, em 2008, na qual foram realizados 21 procedimentos. Complicações fetais como bradicardia e derrame pericárdico foram frequentes (38%). A sobrevida das crianças submetidas ao tratamento fetal foi similar a dos fetos submetidos a tratamento pós-natal. 1
Em 2017, Jantzen et al. analisaram dados de 13 instituições, incluindo do Hospital do Coração – Hcor, em São Paulo, Brazil. Quarenta e sete fetos foram submetidos a intervenções, que incluiram septoplastias atriais (perfuração do septo e dilatação com balão; 27 casos) e colocação de stents no septo atrial (20 casos). Destes, 36 (36/47 – 77%) casos foram bem-sucedidos. Houve tendência a mais sucesso (p = 0,16) nos fetos submetidos a septoplastias (85%) do que a colocação de stent (65%). Isso se deve, pelo menos em parte, ao reduzido número de casos comparados. Complicações fetais foram comuns e morte fetal relacionada ao procedimento ocorreu em seis (13%) casos. Apenas 18/41 (45%) dos fetos vivos apresentaram forame oval não-restrito após o nascimento. Houve tendência a melhor desempenho (p = 0,075) dos stents do que das septoplastias para manutenção do forame oval não restrito (75% x 39%). A sobrevida geral foi baixa (35%) e não houve diferença entre os grupos submetidos ou não ao procedimento cardíaco fetal. Os dados pós-natais foram obtidos em 75% (18/24) dos sobreviventes, com 59% de sobrevivência em um ano nos fetos submetidos a septostomia e 19% nos fetos não submetidos ao procedimento intra-uterino. 5
Esta análise confirmou a gravidade da história natural da doença. A cirurgia fetal bem-sucedida foi associada a maior estabilidade neonatal, evidenciada por diminuição no número de intervenções pós-natais imediatas, bem como na necessidade de ressuscitação neonatal. 5
As intervenções no septo atrial fetal parecem promissoras. Avaliação de um número maior de casos é necessária para que se possa concluir de forma mais objetiva sobre os resultados do procedimento em curto e longo prazo.
Registro Internacional de Intervenção Cardíaca Fetal
Devido a raridade dos casos elegíveis para as intervenções cardíacas fetais, avaliações prospectivas e ensaios clínicos randomizados com tamanhos amostrais apropriados são improváveis. Diante disso, em 2010, foi proposto o início de um registro internacional de procedimentos. O objetivo é permitir um rápido acúmulo de dados provenientes das experiências de diversos centros espalhados pelo mundo.1 O Registro Internacional de Intervenção Cardíaca Fetal (IFCIR) inclui 35 centros de cirurgia fetal, inclusive o Hospital do Coração – Hcor, em São Paulo, trabalhando juntos na aquisição dos dados referentes a cirurgia cardíaca. Em 5 anos desde a fundação, foram coletados 450 casos. 1
Considerações Finais
Diante dos dados disponíveis na literatura, as intervenções cardíacas fetais podem ser oferecidas em casos extremamente específicos e bem selecionados.
A intervenção deve ser realizada em centros especializados e multidisciplinares de cirurgia fetal, seguindo protocolos rígidos, com permissão do Comitê de Ética e consentimento informado do casal. Os riscos maternos devem ser mínimos e aceitáveis. O parto deverá ocorrer em centro de referência de cardiologia neonatal.
Avanços recentes no desenvolvimento de válvulas cardíacas de tecidos autólogos baseadas em células ou em compostos biodegradáveis acelulares para regeneração de tecido endógeno vêm sendo desenvolvidos. Estudos em animais estão sendo conduzidos e a substituição valvar fetal poderá ser uma realidade a ser discutida em breve.

Fig. 1. Sistema pré-marcado utilizado para realizar os procedimentos cardíacos fetais. O fio é protegido com uma fita com a sua ponta avançando de 1 a 2 cm além da ponta do balão do cateter. O eixo do balão do cateter é marcado com uma fita que encosta o cubo da agulha quando o sistema é avançado através dele.
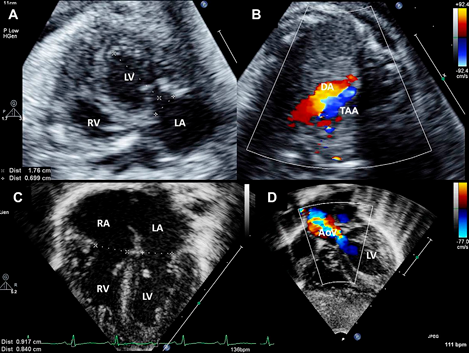
Fig.2. Resultados após valvuloplastia aórtica em feto com estenose aórtica crítica evoluindo para hipoplasia do coração esquerdo. Visões ecocardiográficas fetais e neonatais. (A) Ventrículo esquerdo com forma globosa devido à disfunção sistólica grave. (B) Reversão do fluxo no arco aórtico fetal conforme determinado pelo mapeamento de fluxo de cor (cor vermelha). (C) Vista de quatro câmaras no período neonatal mostrando tamanho adequado do ventrículo esquerdo e válvula mitral. (D) Corte subcostal de eixo longo no período neonatal mostrando aceleração do fluxo através da válvula aórtica. A função ventricular esquerda normal. Foi realizada uma circulação biventricular após a valvoplastia aórtica. AoV, válvula aórtica; DA, ducto arterioso; LA, átrio esquerdo; LV, ventrículo esquerdo; RA, átrio direito; RV, ventrículo direito; TAA, arco aórtico reverso.
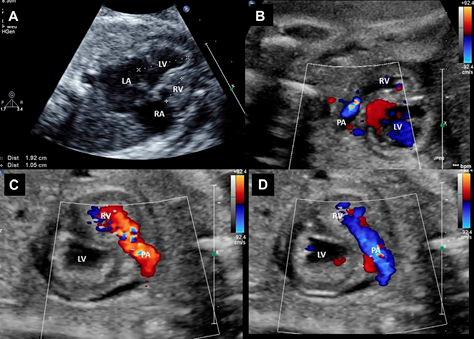
Fig. 3. Resultados após valvoplastia pulmonar fetal para estenose valvar pulmonar crítica e ventrículo direito hipoplásico. Visões ecocardiográficas fetais. (A) Corte de quatro câmaras evidenciando ventrículo direito hipertrofiado (não atinge o ápice cardíaco). (B) A aceleração do fluxo é observada através da válvula pulmonar neste feto com estenose crítica da válvula pulmonar e reversão do fluxo no ducto. (C) Insuficiência pulmonar no feto após valvoplastia com balão bem-sucedida conforme determinado pelo mapeamento de fluxo de cor (cor vermelha). (D) Fluxo direto desobstruído através da válvula pulmonar no feto após valvoplastia de balão bem-sucedida conforme determinado pelo mapeamento de fluxo de cor (cor azul). LA, átrio esquerdo; LV, ventrículo esquerdo; PA, artéria pulmonar; RA, átrio direito; RV, ventrículo direito.
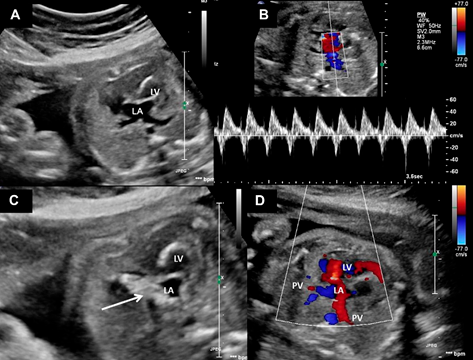
Fig. 4. Sepostomia atrial fetal em paciente com síndrome do coração esquerdo hipoplásico e comunicação interatrial restritiva. Visões ecocardiográficas. (A) O átrio esquerdo e as veias pulmonares estão dilatados. (B) Padrão Doppler na veia pulmonar mostrando fluxo bidirecional (C) Balão (seta) inflado através do septo interatrial após a punção. (D) Resultado imediato após o procedimento mostrando redução no tamanho do átrio esquerdo e fluxo através do septo interatrial (cor vermelha). LA, átrio esquerdo; LV, ventrículo esquerdo; PV, veia pulmonar.
Leituras Suplementares
1. Moon-Grady AJ, Morris SA, Belfort M, Chmait R, Dangel J, Devlieger R, Emery S, Frommelt M, Galindo A, Gelehrter S, Gembruch U, Grinenco S, Habli M, Herberg U, Jaeggi E, Kilby M, Kontopoulos E, Marantz P, Miller O, Otaño L, Pedra C, Pedra S, Pruetz J, Quintero R, Ryan G, Sharland G, Simpson J, Vlastos E, Tworetzky W, Wilkins-Haug L, Oepkes D. International Fetal Cardiac Intervention Registry: A Worldwide Collaborative Description and Preliminary Outcomes. J Am Coll Cardiol. 2015; 28;66(4):388-99.
2. Pedra SF, Peralta CF, Pedra CAC. Future Directions of Fetal Interventions in Congenital Heart Disease. Intervent Cardiol Clin 2 (2013) 1–10.
3. Butera G, Cheatham J, Pedra CAC, Schrans D, Tulzer G. Fetal and hybrid procedures in congenital heart diseases. Springer, 2016
4. Sizarov A, Boudjemline Y. Valve Interventions in Utero: Understanding the Timing, Indications, and Approaches. Can J Cardiol. 2017; 33(9):1150-1158.
5. Jantzen DW, Moon-Grady AJ, Morris SA, Armstrong AK, Berg C, Dangel JH, Fifer CG, Frommelt M, Gembruch U, Herberg U, Jaeggi ET, Kontopoulos EV, Marshall AC, Miller O, Oberhoffer R, Oepkes D, Pedra CA, Pedra SR, Peralta F, Quintero RA, Ryan G, Gelehrter SK. Hypoplastic Left Heart Syndrome with Intact or Restrictive Atrial Septum: A Report from the International Fetal Cardiac Intervention Registry. Circulation. 2017 Sept 1.
